FUERZAS INTRAMOLECULARES
Las fuerzas intramoleculares como los enlaces químicos son todas aquellas que ocurren dentro de una propia molécula.
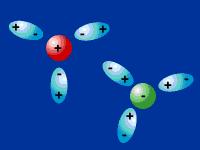
IÓN - IÓN
Los iones con distinta carga se atraen y con carga del mismo signo se repelen, esto no significa que formen enlaces necesariamente, si no una simple interacción molecular.
este tipo de unión se da entre iones. Su fuerza disminuye con la distancia y es la responsable de los elevados puntos de fusión y ebullición de los compuestos iónicos.
ION - DIPOLO
Si dentro del solvente no existen iones que interaccionen con un soluto ionico, aun así las moléculas polares solvatan a los iones solubles de acuerdo a su atracción con las cargas parciales.
Este tipo de fuerzas disminuye con el cuadrado de la distancia. Las interacciones ión-dipolo son las responsables de la hidratación de los cationes en disolución acuosa, es decir, la unión de moléculas de agua en torno a un ion central.
INTERACCIONES HIDROFÓBICAS
Es la ausencia de interacción de algún soluto con agua. Por ejemplo, gracias a la membrana plasmática de una celula (lipidos hidrofobicos) se evita que el contenido del citoplasma se disuelva.
Básicamente la hidrofobicidad ocurre cuando la molécula en cuestión no es capaz de interaccionar con las moléculas de agua ni por interacciones ión-dipolo ni mediante puentes de hidrógeno. Tal es el caso de los hidrocarburos saturados. En esta situación las moléculas de agua en la vecindad del hidrocarburo se orientan y se asocian formando una estructura parecida al hielo, creándose una especie de jaula de moléculas de agua alrededor de la molécula hidrofóbica.
Hecho por: García Pulido Jorge Luis, Roberto Felipe Ramos Monroy y Tinado Chávez Mitzy Janteh.
FUENTES:
Comentarios
Publicar un comentario