FUERZAS INTERMOLECULARES
Las fuerzas intermoleculares son aquellas que ocurren o que tienen lugar entre moléculas distintas.
Estas fueras son mas débiles, sin embargo la suma de todas impacta significativamente sobre las propiedades del material que constituyen o conforman.
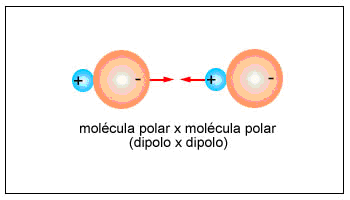
DIPOLO - DIPOLO
Son fuerzas de atracción o repulsión que ocurren entre las cargas parciales de los momentos dipolares entre moléculas vecinas.
DISPERCIÓN DE LONDON
Son momentos dipolares momentáneos que ocurren al distorsionar las nubes electrónicas cuando hay una colisión entre moléculas. En las moléculas polares estas son insignificantes en comparación con las dipolo, sin embargo en las moléculas no polares estas son el tipo de interacción más importante.
DIPOLO - INDUCIDO
Es la distorción de la nube electrónica de una molécula no polar cuando se aproxima una molécula polar (sobre todo entre mas electronegativo sea un átomo).
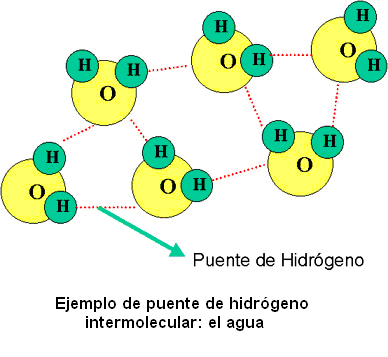
PUENTES DE HIDRÓGENO
El enlace de por puente de hidrógeno en realidad no es un enlace propiamente dicho, sino que es la atracción experimentada por un átomo electronegativo y un átomo de hidrógeno que están formando parte de distintos enlaces covalentes polares. El átomo con mayor electronegatividad atraerá hacia si los electrones del enlace, formándose un dipolo negativo, mientras que el átomo de hidrógeno, al ceder parcialmente sus electrones, genera un dipolo de carga positiva en su entorno. Estas cargas opuestas se atraen. El puente de hidrógeno es un caso especial de la interacción dipolo-dipolo. El enlace por puente de hidrógeno puede ser intermolecular (en el caso del agua por ejemplo) o puede darse también dentro de una misma molécula, siendo denominado en este caso puente de hidrógeno intramolecular.
PUENTE DISULFURO
Un puente disulfuro es un enlace covalente formado por dos grupos sulfidrilo (-SH), cada uno de ellos perteneciente a un residuo de cisteína, se unen de manera covalente para formar un residuo de cistína. Los dos residuos que forman al puente, pueden estar separados por muchos aminoácidos en la secuencia o bien pueden pertenecer a diferentes cadenas polipeptídicas; el plegamiento de la(s) cadena(s) polipeptídicas, lleva a los residuos de cisteína a estar muy próximos, lo que permite la formación del enlace disulfuro.
Las fuerzas de van der Waals son fuerzas de estabilización molecular (dan estabilidad a la unión entre varias moléculas), también conocidas como atracciones intermoleculares o de largo alcance y son las fuerzas entre moléculas (fuerzas entre molecula-molecula).
Son fuerzas mas débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción.
FUENTES:
Hecho por: Garcia Pulido Jorge Luis, Ramos Monroy Roberto Felipe y Tiznado Chávez Mitzy Janeth

Comentarios
Publicar un comentario